Đáp án Bài 4
4.1. C.
4.2. C.
4.3. C (lớp M có 3 phân lớp).
4.4. D.
(với n = 5 số electron tối đa là 2.52 = 50).
4.5. B.
4.6. Số đơn vị điện tích hạt nhân Z = số proton = số electron = số thứ tự.
4.7.
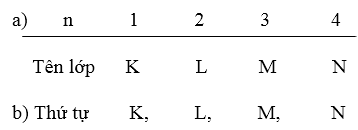
4.8. Số phân lớp trong mỗi lớp trùng với số nguyên n, đặc trưng cho lớp :
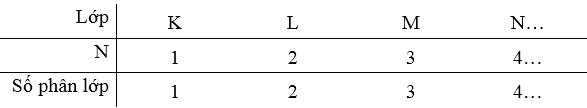
4.9.
a) Lớp N ứng với n = 4 có 4 phân lớp : 4s, 4p, 4d, 4f.
b) Các mức năng lượng tăng dần theo thứ tự trên.
4.10. Số electron tối đa có thể phân bố trên :
– Phân lớp s : 2.
– Phân lớp p : 6.
– Phân lớp d : 10.
– Phân lớp f : 14.
Nhận xét: Số electron tối đa trên các phân lớp s, p, d, f gấp 2 lần các số lẻ liên tiếp 1, 3, 5, 7.
4.11.
a) Một cách vắn tắt người ta nói lớp n có tối đa 2n2 electron.
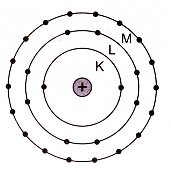 b) Số electron tối đa trên lớp K(n= 1) là
b) Số electron tối đa trên lớp K(n= 1) là = 2.
Số electron tối đa trẽn lớp L (n = 2) là = 8.
Số electron tối đa trên lớp M (n = 3) là =18.
c) Sơ đồ như hình vẽ :
(Lớp K có tối đa 2 electron, lớp L có tối đa 8 electron, lớp M có tối đa 18 electron).
4.12. Lớp M (n = 3) có 3 phân lớp, năng lượng tăng dần từ 3s đến 3d : 3s, 3p, 3d.
4.13. Cấu hình e của nguyên tử A : .
=> Nguyên tử A có 4 lớp e. Có 2 e ở Ịớp ngoài cùng (lớp thứ 4) => là kim loại (những nguyên tử có từ 1 đến 3 e ở lớp ngoài cùng), ZA = 20 => A là Ca.
4.14. Nguyên tố A là một trong ba trường hợp sau :
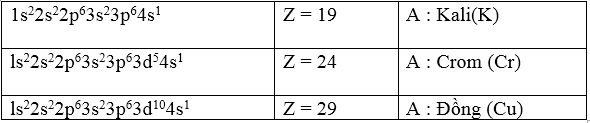
Nguyên tố B là silic : (Z = 14).
4.15.
X : Các phân lớp p của X có 7 e => có 2 phân lớp p => và
=> Cấu hình e của X : => Z = 13 (Al)
Số hạt mang điện của X là = 26
=> Số hạt mang điện của Y : 26 + 8 = 34 => = 17 (Cl).



Trackbacks