Đáp án Bài 33
33.1. C.
33.2. B.
33.3. Số electron của chất bằng tổng số electron của các nguyên tử tạo nên chất. Nếu là ion âm (anion) ta phải cộng thêm số electron bằng số điện tích của ion đó.
Đáp án D.
33.4. 1 – c ; 2 – e ; 3 – b ; 4 – a.
33.5. D.
33.6*. Sau khi cân bằng, ta có PTHH :
![]() Trong số 6 phân tử
Trong số 6 phân tử tham gia phản ứng có 3 phân tử bị khử tạo thành 3 phân tử
và 3 phân tử
tạo ra một phân tử
.
Trả lời : Đáp án D.
33.7. C.
33.8.
– Dùng quỳ tím để phân thành hai nhóm chất :
• Nhóm 1 : HCl, .
• Nhóm 2 : NaCl, .
– Thuốc thử được chọn thêm có thể là dung dịch để phân biệt từng chất có trong mỗi nhóm chất:
• Chất nào ở nhóm 1 tạo kết tủa trắng với dung dịch , chất đó là
. Chất còn lại là HCl.
• Chất nào ở nhóm 2 tạo kết tủa trắng với dung dịch , chất đó là
. Chất còn lại là NaCl.
Viết PTHH của các phản ứng.
33.9.
a) . Viết PTHH của
với
và
.
b) HCl. Viết PTHH của HCl với kim loại và với .
c) . Viết PTHH của dung dịch
với Fe và
với
(phản ứng với Fe,
là chất oxi hoá ; phản ứng với
là chất khử).
d) S. Viết PTHH của S với kim loại và S với oxi.
33.10.
a) Mg + dung dịch loãng sinh ra khí hiđro. Viết PTHH.
b) Cu + đặc sinh ra khí
. Viết PTHH.
c) + dung dịch
loãng, sinh ra khí
. Viết PTHH.
33.11.
a) Dung dịch loãng có tính chất chung của axit. Các thí nghiệm chứng minh :
Thí nghiệm 1. Fe +
Thí nghiệm 2. ZnO +
Thí nghiệm 3. +
Thí nghiệm 4. NaOH + (dùng giấy quỳ tím chứng minh có phản ứng hoá học xảy ra).
b) Các thí nghiệm chứng minh có tính chất hoá học đặc trưng :
Thí nghiệm 5. Cu + (đặc) – Tính oxi hoá mạnh.
Thí nghiệm 6. +
(đặc) – Tính háo nước và tính oxi hoá.
33.12. Viết các PTHH :
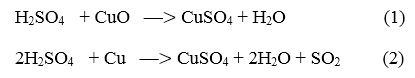
Theo (1) : Muốn điều chế được 1 mol , cần 1 mol
.
Theo (2) : Muốn điều chế được 1 mol , cần 2 mol
.
Kết luận : Phương pháp thứ nhất tiết kiệm được một nửa lượng axit sunfuric.
33.13.
a) Khí , khẳng định bằng dung dịch
.
b) Khí , khí clo ẩm có tính tẩy màu.
c) Khí , cháy trong không khí kèm theo tiếng nổ nhỏ.
d) Khí , khí này làm mất màu dung dịch
.
e) Khí , khí này làm than hồng bùng cháy.
Viết các PTHH của các phản ứng.
33.14. Các PTHH cho những biến đổi:
1) Đốt khí trong oxi hoặc không khí dư :
![]()
2) Dùng oxi hoá khí
:
![]()
3) Dùng Cu khử đặc :
![]()
4) Dùng khí oxi để oxi hoá với xúc tác
:
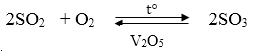
5) Cho tác dụng với
:
![]()
6) Đốt lưu huỳnh trong oxi hoặc trong không khí:
![]()
7) Dùng khử
:
![]()
33.15.

33.16.
a) PTHH: 2KCl + (đặc) →
+ 2HCl ↑
b) Khối lượng muối trong hỗn hợp :
Đặt x và y là số mol KCl và trong hỗn hợp. Ta có :
74,5x+ 174y= 1,143 (1)
Khối lượng sau phản ứng bao gồm khối lượng
vốn có trong hỗn hợp ban đầu và khối lượng
sinh ra sau phản ứng (m = 174.0,5x = 87x). Ta có :
87x+ 174y= 1,218 (2)
Giải hệ phương trình (1) và (2), được x = 0,006 ; y = 0,004.
Khối lượng KCl là : 74,5.0,006 = 0,447 (g).
Khối lượng là : 1,143 – 0,447 = 0,696 (g).
33.17.
a) CácPTHH:
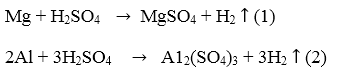
b) Khối lượng kim loại trong hỗn hợp :
– Số mol sinh ra ở (1) và (2) : n
= 8,96 / 22,4 = 0,4 (mol).
– Đặt x và y là số mol Mg và AI có trong hỗn hợp. Từ (1) và (2) ta có hệ phương trình đại số :
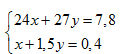
Giải hệ phương trình, ta được x = 0,1 và y = 0,2.
Khối lượng các kim loại:
= 24.0,1 = 2,4 (g)
= 27.0,2 = 5,4 (g)
c) Thể tích dung dịch tham gia phản ứng :
– Số mol tham gia (1) và (2) là :
0,1 + 0,3 = 0,4 (mol)
– Thể tích dung dịch là :
= 0,4 / 2 = 0,2 (lít) hay 200 ml.
33.18.
không biết là loãng hay đặc, khí thoát ra không biết là
hay là
nên chưa kết luận được
• Nếu là loãng —> phản ứng với Fe tỉ lệ 1 : 1 —> loại
• Nếu đặc, nóng -> phản ứng với Fe tỉ lệ 1 : 3 —> có thêm phản ứng giữa Fe với muối
tạo ra muối
Các phản ứng cho – nhận e xảy ra:
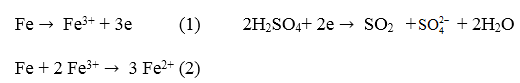
Nếu gọi số mol phản ứng là x thì số mol Fe phản ứng (1) là x/3
Số mol Fe phản ứng (2) là y, vậy ta có :
x/3 + y = 0,375x <=> 24y = x(*)
Mặt khác :
![]()
Thay (*) vào (**) giải được y = 0,0067; x = 0,16
Vậy khối lượng Fe phản ứng là: 0,16.0,375.56 = 3,36 (g).
33.19.
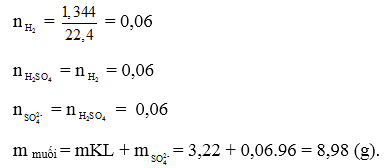
33.20. Các PTHH :
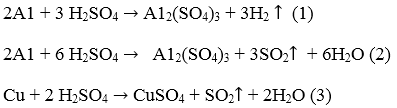
Theo PTHH (1) số mol AI tham gia phản ứng bằng 2/3 số mol .
=> Khối lượng AI trong hỗn hợp : 2. 2/3 .0,06.27 = 2,16 (g)
Số mol được giải phóng bởi AI:
![]()
Theo PTHH (2) và (3) số mol giải phóng bởi Cu : 2.0,1 – 0,12 = 0,08 (mol)
Theo PTHH (3) khối lượng Cu trong hỗn hợp : 0,08, 64 = 5,12 (g)
Vậy m = 2,16 + 5,12 = 7,28 (g).
33.21.




Trackbacks