Đáp án Bài 38
38.1.
Đặc điểm của phản ứng hoá học này là thuận nghịch (phản ứng thuận thu nhiệt) và tất cả các chất tham gia và tạo thành đều là chất khí. Tuy nhiên, tổng số mol khí trước và sau phản ứng không thay đổi, do đó áp suất không ảnh hưởng gì đến sự chuyển dịch cân bằng.
Phương án B sai vì chỉ có một yếu tố ảnh hưởng đến tốc độ phản ứng là nồng độ, còn áp suất thì không.
Phương án C và D sai vì yếu tố xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau, do vậy không làm chuyển dịch cân bằng hoá học.
Do đó, chọn phương án A, nhiệt độ và nồng độ là các yếu tố đều ảnh hưởng đến sự chuyển dịch của cân bằng hoá học trên.
38.2. Đáp án D.
38.3. Câu B đúng.
38.4. C.
38.5. C.
38.6. Phản ứng hoá học khử sắt oxit bằng cacbon monoxit là không hoàn toàn.
38.7.
a) Khi tăng nhiệt độ của bình phản ứng cân bằng hoá học của phản ứng sẽ chuyển dịch về phía nghịch, vì phản ứng thuận toả nhiệt.
b) Khi tăng áp suất chung của hỗn hợp, cân bằng hoá học của phản ứng sẽ chuyển dịch về chiều thuận vì sau phản ứng có sự giảm thể tích.
c) Khi tăng nồng độ khí oxi cân bằng hoá học của phản ứng sẽ chuyển dịch về phía thuận.
d) Khi giảm nồng độ khí sunfurơ cân bằng hoá học của phản ứng sẽ chuyển dịch về chiều nghịch.
38.8.
a) Khi tăng nhiệt độ, cân bằng hoá học của phản ứng sẽ chuyển sang chiều nghịch. Bởi vì phản ứng thuận toả nhiệt.
b) Khi tăng áp suất chung, cân bằng hoá học của phản ứng sẽ chuyển sang chiều thuận. Bởi vì sau phản ứng thuận có sự giảm thể tích khí.
c) Khi thêm khí trơ agon và giữ áp suất không đổi thì nồng độ của hai khí đều giảm, tuy nhiên tốc độ phản ứng thuận sẽ giảm nhanh hơn và do đó cân bằng hoá học của phản ứng sẽ chuyển sang chiều nghịch.
d) Thêm chất xúc tác không làm chuyển dịch cân bằng hoá học.
38.9. Nước clo dần dần bị mất màu theo thời gian, không bảo quản được lâu là do quá trình phân huỷ HCIO :
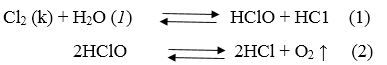
Phản ứng (2) làm cho nồng độ HCIO giảm, cân bằng hoá học của phản ứng (1) chuyển dịch theo chiều thuận, clo sẽ phản ứng với nước cho đến hết, do đó nước clo không bền.
38.10.
a) Các đặc điểm của phản ứng hoá học nung vôi:
– Phản ứng thuận nghịch.
– Phản ứng thuận thu nhiệt.
– Phản ứng thuận có sản phẩm tạo thành là chất khí.
b) Những biện pháp kĩ thuật để nâng cao hiệu suất nung vôi :
– Chọn nhiệt độ thích hợp.
– Tăng diện tích tiếp xúc của chất rắn () bầng cách đập nhỏ đá vôi đến kích thước thích hợp.
– Thổi không khí nén (trong công nghiệp) hay chọn hướng gió thích hợp để tăng nồng độ khí oxi cung cấp cho phản ứng đốt cháy than, đồng thời làm giảm nồng độ khí cacbon đioxit.
38.11.
– Phản ứng trên không có sự thay đổi về số mol khí trước và sau phản ứng, do đó áp suất không có ảnh hưởng đến sự chuyển dịch cân bằng.
– Phản ứng thuận thu nhiệt, do đó tăng nhiệt độ làm cân bằng chuyển sang chiều thuận.
– Tăng nồng độ các chất A và B hay giảm nồng độ C cũng làm chuyển dịch cân bằng sang chiều thuận.
38.12.
Theo nguyên lý chuyển dịch cân bằng Lơ-sa-tơ-lie: khi giảm áp suất của hệ, cân bằng sẽ chuyển dịch theo chiều làm tăng áp suất của hệ —> do đó chỉ có cân bằng (IV) là chuyển dịch theo chiều nghịch.
38.13.
a) Khi tăng nồng độ [] : cân bằng dịch chuyển theo chiều làm giảm [
], tức là chiều thuận, chiều tạo ra
, nên [
] tăng.
b) Khi giảm áp suất : cân bằng dịch chuyển theo chiều làm tăng áp suất tức là chiều làm tăng số mol khí, đó là chiều nghịch, vì vậy [] giảm.
c) Khi nhiệt độ tăng, cân bằng dịch chuyển theo chiều thu nhiệt tức là chiều nghịch. Vì phản ứng trên, chiều thuận có ΔH < 0 (là phản ứng toả nhiệt), nên [] giảm.
38.14.
a) (1) chiều thuận; (2) chiều nghịch.
b) (1) chiều thuận; (2) chiều thuận.
c) (1) chiều thuận; (2) chiều thuận.
d) (1) chiều nghịch; (2) không đổi.



Trackbacks