Đáp án Bài 10
10.1. Đáp án D.
10.2. Đáp án C.
10.3.
a) Đáp án C (xesi).
b) Đáp án A (flo).
10.4.

=> Đáp án A.
10.5.
a) Số proton là 20, số electron là 20.
b) X :
c) Có 4 lớp electron, lớp ngoài cùng có 2 electron.
10.6.
a) Số proton là 14, số thứ tự là 14.
b) Nguyên tử có 3 lớp electron, lớp ngoài cùng có 4 electron.
c) Nguyên tố thuộc chu kì 3, nhóm IVA.
10.7.
a) Magie (Mg) có tính kim loại yếu hơn tính kim loại của natri (Na) đứng trước và mạnh hơn tính kim loại của nhôm (Al) đứng sau.
b) Magie (Mg) có tính kim loại yếu hơn tính kim loại của canxi (Ca) đứng dưới và mạnh hơn tính kim loại của beri (Be) đứng trên.
10.8.
a) Vì nguyên tố X hợp với hiđro cho hợp chất nên nguyên tố đó thuộc nhóm IVA. Oxit cao nhất của nó sẽ là
.
Theo đề bài ta có :
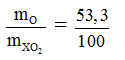
( là khối lượng của nguyên tố o,
là khối lượng của
).
Nguyên tử khối của oxi là 16. Gọi X là nguyên tử khối của X, ta sẽ có :
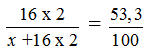
Từ đó ta có : 53,3 . (x + 32) = 100.32
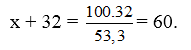
Nguyên tử khối của X :
X = 60 – 32 = 28.
b) X thuộc nhóm IVA, có số khối là 28.
Vậy nguyên tố đó là silic (Si).
10.9.
Mối quan hệ giữa hai hoá trị của nguyên tố X là :
a + b = 8
10.10.
B : →
= R / (R+3) .100 = 82,35 => R = 14 (N)
→ A, B là và
10.11.
A : , B :
→ (Y + 2) / ( Y + 48) = 0,425
→ Y = 32(S) → A : là ; B là
10.12.
Cấu hình e đầy đủ của X : → Z = 13 = STT, chu kì 3 (có
3 lớp e), nhóm IIIA, (có 3 lớp electron ngoài cùng, là nguyên tố p), kim loại.



Trackbacks