I.KIẾN THỨC CẦN NHỚ
1.Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
-Hiện nay bảng tuần hoàn có hơn 100 nguyên tố.
-Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2.Cấu tạo bảng tuần hoàn
a.Ô nguyên tố
-Ô nguyên tố cho biết: số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố.
-Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Số hiệu nguyên tử là số thứ tự của nguyên tố trong bảng tuần hoàn.
b.Chu kì
-Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được sắp xếp theo chiều điện tích hạt nhân tăng dần.
-Số thứ tự của chu kì bằng số lớp electron.
c.Nhóm
-Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và do đó có tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử.
-Số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử.
II.GIẢI BÀI TẬP
Bài 1. Trang 101 sách giáo khoa hóa học 9
-Nguyên tố số hiệu 7 là N thuộc nhóm chu kì 2, và nhóm V
+ Hạt nhân có 7+ điện tích nguyên tố, lớp vỏ có 7 electron chia thành 2 lớp, lóp trong có 2 electron và lớp ngoài có 5 electron.
+ Nguyên tố N thể hiện tính chất phi kim.
+Nguyên tô có số hiệu 12 là Mg thuộc chu kì 3, nhóm II.
+ Hạt nhân có 12+ điện tích nguyên tố, lớp vỏ có 12 electron chia thành lớp, lớp trong cùng có 2 electron, lớp giữa có 8 electron và lớp ngoài có 2 electron
+ Nguyên tố Mg thể hiện tính chất kim loại.
-Nguyên tố có số hiệu 16 là S thuộc chu kì 3 và nhóm VI.
+ Hạt nhân có 16+ điện tích nguyên tố, lớp vỏ có 16 electron chia thành 3 lớp, lớp trong cùng có 2 electron, lớp giữa có 8 electron và lớp ngoài cùng có 6 electron.
+ Nguyên tố S thể hiện tính chất phi kim:
Bài 2. Trang 101 sách giáo khoa hóa học 9
-Vị trí của X trong bảng tuần hoàn hóa học:
+ Chu kì 3; nhóm I; ô số II; là Na.
Tính chất hóa học cơ bản là tính kim loại:
2Na + Cl2 → 2NaCl
4Na + O2 → 2Na2O
2Na + 2HCl -+ 2NaCl + H2 ↑
2Na + 2H2O → 2NaOH + H2 ↑
Bài 3. Trang 101 sách giáo khoa hóa học 9
2K + Cl2 → 2KCl
4K + O2 → 2K2O
2K + 2HCl → 2KCl + H2 ↑
2K + 2H2O → 2KOH + H2↑
Bài 4. Trang 101 sách giáo khoa hóa học 9
2Na + Br2 → 2NaBr
H2 + Br2 → 2HBr
Bài 5. Trang 101 sách giáo khoa hóa học 9
Chọn phương án b. Vì trong nhóm I, K đứng sau Na. Trong chu kì 3 tính kim loại của Na lớn hơn Mg cuối cùng là Al.
Bài 6. Trang 101 sách giáo khoa hóa học 9
-Thứ tự các nguyên tố theo chiều tính phi kim tăng dần: As, P, N, O, F.
-As, P , N là những nguyên tố phi kim cùng nhóm V, từ As → N theo chiều điện tích hạt nhân giảm dần tính phi kim tăng.
– O và F cùng chu kì 2, theo chiều điện tích hạt nhân tăng tính phi kim tăng.
Bài 7. Trang 101 sách giáo khoa hóa học 9
a.
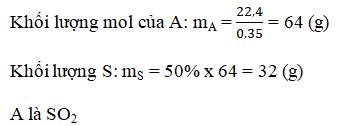
b.
Xác định muối tạo thành sau phản ứng
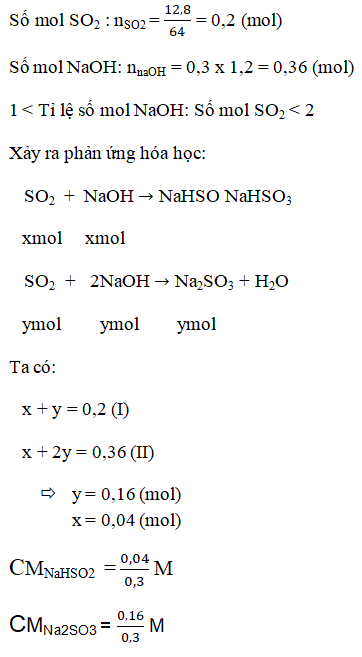

Comments mới nhất