Vị trí và cấu tạo của kim loại
I. KIẾN THỨC CẦN NHỚ
Trong bảng tuần hoàn có gần 90 nguyên tố là kim loại. Các nguyên tố kim loại có mặt ở: nhóm IA (trừ hiđro), nhóm IIA, nhóm IIIA (trừ bo) và một phần nhóm IVA, VA, VIA; các nhóm B (từ IB đến VIIIB); họ lantan và actini được xếp riêng thành 2 hàng ở cuối bảng.
– Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng (1,2 hoặc 3 electron).
– Cấu tạo mạng tinh thể kim loại:
+ Mạng tinh thể lục phương có độ đặc khít 74%.
+ Mạng tinh thể lập phương tâm điện có độ đặc khít 74%.
+ Mạng tinh thể lập phương tâm khối có độ đặc khít 68%.
– Liên kết kim loại: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
II. HƯỚNG DẪN GIẢI BÀI TẬP (SGK)
Bài 1 (Trang 82, SGK)
Trong bảng tuần hoàn có gần 90 nguyên tố kim loại, chúng nằm ở các vị trí như sau:
– Nhóm IA (trừ hiđro) và nhóm IIA, nhóm IIIA (trừ bo) và một phần của các nhóm IVA, VA, VIA.
– Các nhóm B từ IB đến VIIIB.
– Họ lantan và họ actini được xếp riêng thành hai hàng ở cuối bảng.
Bài 2 (Trang 82, SGK)
– Cấu tạo của nguyên tử kim loại:
+ Có số electron hóa trị ít;
+ Trong cùng một chu kì các nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tố phi kim trong cùng chu kì.
– Cấu tạo tinh thể kim loại:
+ Kim loại có cấu tạo tinh thẻ, tinh thể kim loại có cấu tạo mạng;
+ Có 3 kiểu mạng tinh thể phổ biến là: mạng tinh thể lục phương, mạng tinh thể lập phương tâm diện, mạng tinh thể lập phương tâm khối.
Bài 3 (Trang 82, SGK)
* Liên kết kim loại: là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
* So sánh với liên kết ion và liên kết cộng hóa trị.
a. So sánh liên kết kim loại với liên kết cộng hóa trị
– Giống nhau: có sự dùng chung electron.
– Khác nhau:
+ Liên kết cộng hóa trị: sự dùng chung electron giữa hai nguyên tử tham gia liên kết.
+ Liên kết kim loại: sự dùng chung electron toàn bộ electron trong nguyên tử kim loại.
b. So sánh liên kết kim loại với liên kết ion
– Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
– Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
Mở rộng: So sánh liên kết ion và liên kết cộng hóa trị.

Bài 4 (Trang 82, SGK)
Mạng tinh thể kim loại gồm có: nguyên tử, ion kim loại và các electron tự do.
Vì vậy, chúng ta chọn B.
Bài 5 (Trang 82, SGK)
Dãy ,
, Ne gồm các nguyên tử và ion có cấu hình electron: 1
.
Vì vậy, chúng ta chọn D.
Bài 6 (Trang 82, SGK)
Cation có cấu hình electron ở phân lớp ngoài cùng là
.
Nguyên tử R là Na.
Vì vậy, chúng ta chọn B.
Bài 7 (Trang 82, SGK)
Gọi kim loại cần tìm là R. Các phương trình hóa học:
R + →
+
(1)
+ 2NaOH →
+
(2)
Ta có: = 0,15 x 0,5 = 0,075 (mol)
= 0,03 x 1 = 0,03 (mol)
=> (1)= 0,075 – (0,03/2) = 0,06 (mol)
Từ(1)=> =
= 0,06 (mol)
= 1,44/0,06 = 24 (g/mol)
Vậy R là Mg.
Vì vậy, chúng ta chọn C.
Bài 8 (Trang 82, SGK)
Gọi công thức chung của Mg và Zn là M.
M + 2HCl → +
= 0,6/2 = 0,3 (mol)
= 0,6 (mol)
Áp dụng định luật bảo toàn khối lượng, ta có:
m (kim loại) + = m (muối) +
=> m (muối) = 15,4 + 0,6 x 36,5 – 0,6 = 36,7 (g)
Vì vậy, chúng ta chọn A.
Bài 9 (Trang 82, SGK)
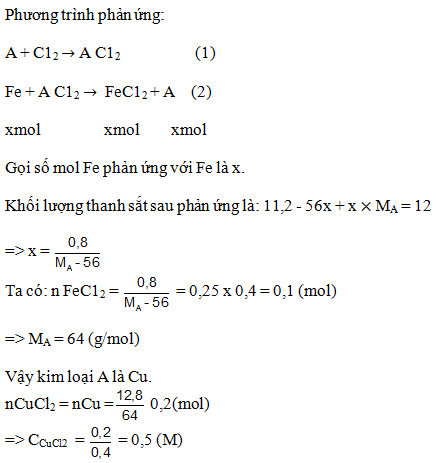
>> Xem thêm Bài 18 : Tính chất của kim loại. Dãy điện hóa của kim loại tại đây.



Comments mới nhất