Bài 17 : Luyện tập chương 2
17.1. Hình dưới đây là sơ đồ tượng trưng cho phản ứng giữa khí hiđro và chất đồng(II) oxit CuO tạo ra kim loại đồng và nước.
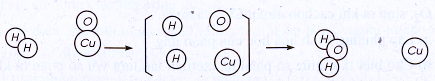
Hãy chỉ ra :
a) Mỗi phản ứng xảy ra với bao nhiêu phân tử của mỗi chất phản ứng, tạo ra bao nhiêu phân tử nước và nguyên tử đồng.
b) Liên kết giữa những nguyên tử trong phân tử nào bị tách rời, trong phân tử nào mới được tạo ra.
17.2.Trong một phản ứng hoá học, các chất phản ứng và các sản phẩm phải chứa cùng :
A. Số nguyên tử trong mỗi chất.
B. Số nguyên tử của mỗi nguyên tố.
C. Số phân tử của mỗi chất.
17.3. Dây tóc trong bóng đèn điện nóng đỏ và phát sáng mỗi khi có dòng điện đi qua. Trường hợp bóng đèn bị rạn nứt và không khí (có khí oxi) chui vào bên trong thì dây tóc bị cháy khi bật công tắc điện. (Xem lại bài tập 2.2 về dây tóc trong bóng đèn điện.)
Hãy phân tích và chỉ ra khi nào xảy ra hiện tượng vật lí, khi nào xảy ra hiện tượng hoá học.
17.4. Đá đôlômit là hỗn hợp hai chất canxi cacbonat CaC và magie cacbonat MgC
. Khi nung nóng, tương tự canxi cacbonat, chất magie cacbonat cũng bị phân huỷ tạo ra chất magie oxit MgO và khí cacbon đioxit.
a) Viết công thức về khối lượng của hai phản ứng xảy ra khi nung nóng đôlômit.
b) Nung nóng 192 kg đôlômit thì có 88 kg khí eacbon đioxit thoát ra. Tính khối lượng của hỗn hợp hai chất canxi oxit và magie oxit.
17.5. Cho sơ đồ của các phản ứng sau :
![]()
![]()
Lập phương trình hoá học của mỗi phản ứng và cho biết tỉ lệ số nguyên tử, số phân tử của hai cặp chất trong phản ứng (tuỳ chọn).
17.6.Biết rằng khí axetilen (khí đất đèn) cháy là xảy ra phản ứng với khí oxi
, sinh ra khí cacbon đioxit C
và nước.
a) Lập phương trình hoá học của phản ứng.
b) Cho biết tỉ lệ giữa số phân tử axetilen lần lượt với số phân tử khí cacbon đioxit và số phân tử nước.
17.7. Biết rằng kim loại nhôm tác dụng với axit suníuric S
tạo ra khí hiđro
và chất nhôm sunfat A
(S
)3.
a) Lập phương trình hoá học của phản ứng.
b) Cho biết tỉ lệ giữa số nguyên tử AI lần lượt với số phân tử của ba chất trong phản ứng.
17.8. Hãy chọn hệ số và công thức hoá học thích hợp điền vào những chỗ có dấu hỏi trong các phương trình hoá học sau (chép vào vở bài tập).
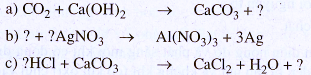
17.9. Cho sơ đồ của phản ứng sau :
![]()
a) Hãy biện luận để thay x, y (biết rằng x ≠ y) bằng các chỉ số thích hợp rồi lập phương trình hoá học của phản ứng.
b) Cho biết tỉ lệ số phân tử của bốn cặp chất trong phản ứng (tuỳ chọn).
17.10.
a) Biết rằng, khí hiđro dễ tác dụng với chất chì(IV) oxit Pb, chiếm lấy oxi của chất này để tạo ra nước.
Viết phương trình hoá học của phản ứng và tên chất mới sinh ra.
b) Biết rằng, 3 g khí hiđro tác dụng vừa đủ với 179,25 g Pb. tạo ra 27 g nước. Tính khối lượng chất mới sinh ra.
17.11. Quặng malachit có thành phần chính là hai hợp chất của đồng được ghi bằng công thức chung là C(0H)2C
. Khi nung nóng thì hai hợp chất này bị phân huỷ, sản phẩm của phản ứng phân huỷ gồm có CuO,
O và C
.
a) Viết phương trình hoá học của phản ứng phân huỷ mỗi hợp chất của đồng.
b) Biết rằng khi nung nóng 4,8 kg quặng thì thu được 3,2 kg CuO cùng với 0,36 kg nước và 0,88 kg C. Tính tỉ lệ phần trăm về khối lượng hai .hợp chất của đồng có chứa trong quặng.
17.12. Để điều chế kali clorua KCL (dùng làm phân bón), người ta cho kim loại kali K tác dụng với khí clo C.
a) Viết phương trình hoá học của phản ứng.
b) Nếu có 6,02.10²³ nguyên tử K, cần lấy vào phản ứng bao nhiêu phân tử C và thu được bao nhiêu phân tử KCL ?
(Xem lại các bài tập 8.9*, 9.6* và 16.8* trước khi làm bài tập này và bài tập tiếp theo).
17.13. Những câu trong bài tập này coi là tiếp theo của bài tập 17.12*.
a) Tính khối lượng bằng gam của :
– 6,02.1 0²³ nguyên tử K,
– 6,02.10²³ phân tử C,
– 6,02.10²³ phân tử KCL.
b) Tính khối lượng khí clo để tác dụng vừa đủ với 39 g kim loại kali.
c) Từ khối lượng kim loại cho biết và khối lượng khí clo tính được trong câu b), tính khối lượng kali clorua thu được theo hai cách.
Xem thêm Mol và tính toán hóa học tại đây

Trackbacks