B. Phần hướng dẫn giải – Đáp số – Chương 6 – Bài 44 : Luyện tập chương 6
44.1. Nồng độ phần trăm của dung dịch pha chế:
– Khối lượng của dung dịch :
![]()
– Nồng độ phần trăm của dung dịch :
![]()
Nồng độ mol của dung dịch pha chế:
– Số mol trong dung dịch :
![]()
– Nồng độ mol của dung dịch :
![]()
44.2. a) Pha chế 50 ml dung dịch 1M :
– Số mol cần dùng là :
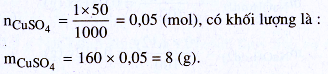
– Cách pha chế:
Cân 8 g cho vào cốc chia độ. Thêm khoảng 25 – 30 ml nước cất vào cốc, dùng đũa thuỷ tinh khuấy cho
tan hết, bỏ đũa ra ngoài, thêm từ từ nước cất cho đủ 50 ml. Trộn đều, ta được 50 ml dung dịch
có nồng độ IM.
b) Pha chế 50 g dung dịch 10% :
– Khối lượng C11SO4 cần dùng là :
![]()
– Khối lượng nước cất cần dùng là :
50 – 5 = 45 (g)
– Cách pha chế:
Cân lấy 5 g cho vào cốc. Rót từ từ vào cốc 45 g hoặc 45 ml nước cất, khuấy cho
tan hết, ta được 50 g dung dịch
10%.
44.3. a) Xem đồ thị
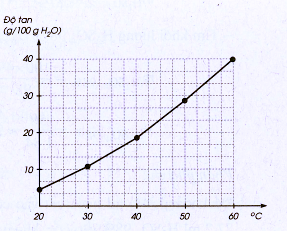
b) ước lương đô tan của muối:
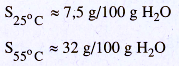
c) Khối lượng muối có trong các
dung dịch bão hoà :
– Ở nhiệt độ 20°C : Độ tan của muối là 5 g, suy ra trong 200 g nước có khối lượng muối tan là :
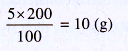
– Ở nhiệt độ 50°C: Độ tan của muối là 28 g, suy ra trong 2 kg (2000 g)
nước có khối lượng muối tan là :
![]()
44.4. Theo độ tan của muối NaCl trong nước ở nhiệt độ 20°C là 32 g, ở nhiệt độ
này 75 g nước hoà tan tối đa được :
![]()
Như vậy, dung dịch NaCl đã pha chế là chưa bão hoà. Để có được dung
dịch NaCl bão hoà ở nhiệt độ này, ta cho thêm vào dung dịch đã pha chế
một khối lượng NaCl là :
24 – 23,5 = 0,5 (g)
Khuấy cho muối tan hết, ta được dung dịch bão hoà NaCl ở 20 °C.
44.5. Phần tính toán :
– Tìm số mol cần dùng để pha chế 500 ml dung dịch
IM :
![]()
![]()
– Tìm khối lượng 98 % có chứa 49 g
:
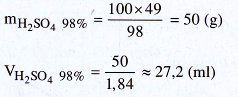
Phần pha chế:
Đổ khoảng 400 ml nước cất vào cốc chia độ có dung tích 1 lít. Rót từ từ 27,2 ml 98% vào cốc, khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500 ml. Ta đã pha chế được 500 ml dung dịch
IM.
44.6. a) Nồng độ mol của dung dịch C :
– Tìm số mol có trong 2V dung dịch A :
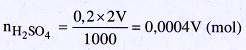
– Tìm số mol có trong 3V dung dịch B :
![]()
– Nồng độ mol của dung dịch sau khi pha trộn :
![]()
b) Pha chế dung dịch 0,3M
Đặt x (ml) và y (ml) là thể tích các dung dịch axit A và B phải lấy để eó dung dịch 0,3M.
– Tìm số mol có trong x (ml) dung dịch A là :
![]()
– Tìm số mol có trong y (ml) dung dịch B là :
![]()
– Từ công thức tính nồng độ mol, ta có :
![]()
Giải phương trình ta có : x = 2y. Nếu y = 1, thì x = 2.
Kết luận : Ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch có nồng độ 0,3M.
44.7. a) Khối lượng dung dịch NaOH 10% phải dùng :
– Đặt X (g) là khối lượng dung dịch NaOH 10% cần dùng.Trong đó chứa khối lượng NaOH là :
![]()
– Khối lượng NaOH có trong dung dịch ban đầu là :
![]()
Theo công thức tính nồng độ phần trăm, ta có phương trình đại số :
![]()
Giải phương trình, ta được : x – 300.
Kết luận : Phải trộn thêm 300 g dung dịch NaOH 10% ta sẽ có 200 + 300 = 500 (g) dung dịch NaOH nồng độ 8%.
b) Khối lượng NaOH cần dùng :
– Đặt x (g) là khối lượng NaOH cần phải pha trộn vào dung dịch A để có dung dịch NaOH 8%.
– Theo công thức tính nồng độ phần trăm, ta có phương trình đại số :
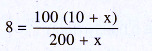
Giải phương trình, ta đựợc x = 6,52 g.
Kết luận : Phải trộn thêm 6,52 g NaOH vào dung dịch A ta sẽ được dung dịch NaOH nồng độ 8%.
c) Khối lượng nước bay hơi:
– Đặt x (g) là khối lượng nước bay hơi khỏi dung dịch để có dung dịch NaOH nồng độ 8%.
– Từ công thức tính nồng độ phần trăm, ta có phương trình đại số :
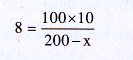
Giải phương trình, ta được : x = 75.
Kết luận : Cho 75 g nước bay hơi ra khỏi 200 g dung dịch NaOH ban đầu, ta được 200 -75 = 125 (g) dung dịch NaOH có nồng độ 8%.

Trackbacks