Đáp án Bài 7
7.1. Đáp án đúng là C, lớp electron ngoài cùng có tối đa 8 electron.
7.2. Ta có:
P + E + N -1 = 57 .⇔ 2P + N = 58 ⇔ N = 58 – 2P (1)
Mặt khác ta có công thức :
1 ≤ N/P ≤ 1,5 (2)
Thay (1) vào (2) ta có :
P ≤ 58 – 2P ≤ 1,5P ⇔ 16,57 ≤ P < 19,33
P có 3 giá trị 17, 18, 19
• p =17 : cấu hình e thu gọn 2/8/7 → loại
• p = 18 : cấu hình e thu gọn 2/8/8 → loại
• p = 19 : cấu hình e thu gọn 2/8/8/1 → chu kì 4 nhóm IA → chọn Đáp án A.
7.3. A.
7.4. Theo đề bài ta có :
2Z+ N = 40 N ≥ Z.
Vì vậy ta có :
3Z ≤ 40, do đó Z ≤ 40/3 = 13,3 (1)
Mặt khác : N/Z ≤ 1,5 → N ≤ 1,5 Z
Từ đó ta có :
2Z + N ≤ 2Z + 1,5Z ; 40 ≤ 3,5Z → Z ≥ 40/3,5 = 11,4 (2)
Tổ hợp (1) và (2) ta có : 11,4 < z < 13,3 mà Z nguyên.
Vậy Z = 12. và z = 13. Nếu Z = 12 thì N = 16 và A = 28 (trái với đề bài A < 28)
Vậy Z = 13. Đó là nguyên tố nhôm (Al).
Vị trí của nhôm trong bảng tuần hoàn :
+ Ô số 13 ;
+ Chu kì 3 ; + Nhóm IIIA.
=> Đáp án A.
7.5.
a) Chu kì 1 có 2 nguyên tố.
Chu kì 2 có 8 nguyên tố.
Chu kì 3 có 8 nguyên tố.
b) Chu kì 4 và chu kì 5, mỗi chu kì có 18 nguyên tế.
c) Chu kì 6 có 32 nguyên tố.
d) Các chu kì 1, 2, 3 là các chu kì nhỏ (ngắn).
Các chu kì 4, 5, 6, 7 là các chu kì lớn (dài).
7.6. Các nguyên tố H và He thuộc chu kì 1. Các nguyên tử này có 1 lớp electron, đó là lớp K (n = 1), có tối đa 2.12 = 2 electron.
7.7. Các nguyên tố Li, Be, B, c, N, o, F, Ne thuộc chu kì 2. Nguyên tử của các nguyên tố này có 2 lớp electron, lớp ngoài cùng là lớp L (n – 2) có tối đa
= 8 electron.
7.8.
a) Bảng tuần hoàn có 18 cột chia thành 8 nhóm A đánh số từ IA đến VIIIA và 8 nhóm B đánh số từ IB đến VIIIB. Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
b) Các nguyên tử của các nguyên tố thuộc cùng một cột có cấu hình electron tương tự nhau, đặc biệt là cấu hình electron ở lớp ngoài cùng. Do đó các nguyên tố này có tính chất hoá học gần giống nhau.
7.9.
a) Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA, được gọi là nhóm kim loại kiềm và nhóm IIA, được gọi là nhóm kim loại kiềm thổ.
b) Khối các nguyên tố p gồm các nguyên tố thuộc 6 nhóm, từ MA đến VIIIA.
c) Khối các nguyên tố d gồm các nguyên tố Sc, Y, La, Ac thuộc nhóm IIIB và các nguyên tố thuộc các nhóm IVB, VB, VIB, VIIB, VIIIB, IB, IIB.
d) Khối các nguyên tố f gồm 14 nguyên tố thuộc họ Lantan và 14 nguyên tố thuộc họ Actini. Các nguyên tố này được xếp riêng ngoài bảng thành hai hàng ngang, ghi ở dưới bảng.
7.10.
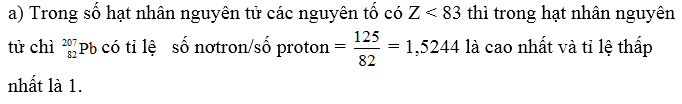
Như vậy điều kiện bền của hạt nhân là :
1 ≤ số n/số p ≤ 1,5244.
b) Đối với 20 nguyên tố đầu tiên, trừ hiđro thì tỉ số N / Z đối với hạt nhân nguyên tử liti là lớn nhất và bằng : N / Z = 4/3 = 1,33. Và tỉ số thấp nhất N / Z = 1 (đối với hạt nhân của nguyên tử C, O,…).
7.11.
– Trong nguyên tử thì tỉ số N / Z ≥ 1 và N / Z ≤1,5.
– Trong nguyên tử số proton bằng số electron.
Theo đầu bài tổng 3 loại hạt là 13. Ta có thể biện luận như sau :
+ Nếu số p = số e = 3 thì số n = 13 – (3 + 3) = 7.
Tỉ số N / Z = 7/3 = 2,3 > 1,5 (loại).
+ Nếu số p = số e = 4 thì số n = 13 – (4 + 4) = 5.
Tỉ số = N / Z = 5/4 = 1,25 (phù hợp).
+ Nếu số p = số e = 5 thì số n = 13 – (5 + 5) = 3.
Tỉ số = N / Z = 3/5 = 0,6 < 1 (loại)
Vậy nguyên tử đó có Z = 4. Đó là beri (Be).
Nguyên tử khối của nguyên tố đó là : 4 + 5 = 9 đvC.
Cấu hình electron nguyên tử : .



Trackbacks