Đáp án Bài 32
32.1. D.
32.2. D.
32.3. C.
32.4. A.
32.5. B.
32.6.
a) Nhận xét:
– Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với ở thí nghiệm 1 lớn hơn, trong khi đó nhiệt độ của dung dịch axit là như nhau.
– Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.
b) Đồ thị biểu diễn các phản ứng :
– Đường cong c biểu diễn cho thí nghiệm 1, phản ứng xảy ra nhanh nhất.
– Đường cong b biểu diễn cho thí nghiệm 3, phản ứng xảy ra nhanh trung bình.
– Đường cong a biểu diễn cho thí nghiệm 2, phản ứng xảy ra chậm nhất.
c) Thể tích khí hiđro :
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng tham gia phản ứng :
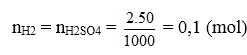
Thể tích khí hiđro ở điều kiện phòng là :
![]()
Ta ghi số 2400 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).
32.7.
a) PTHH : FeS + 2HCl → +
↑
b) Đồ thị biểu diễn khí sinh ra :
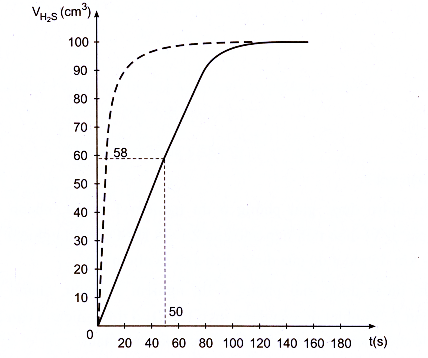
c) Căn cứ vào đồ thị, ta biết:
– Thể tích khí thu được ở thời điểm 50 giây khoảng 58
.
– Trong khoảng 20 giây đầu, phản ứng xảy ra nhanh nhất (đường cong có độ dốc lớn nhất). Khoảng thời gian 20 giây từ giây thứ 120 đến 140, phản ứng xảy ra chậm nhất (đường cong có độ dốc nhỏ nhất).
– Phản ứng kết thúc ở giây thứ 140.
d) Nếu thay dung dịch HCl có nồng độ cao hơn thì đường cong sẽ có độ dốc lớn hơn, phản ứng sẽ kết thúc nhanh hơn, nhưng thể tích khí thu được là không đổi. Trên đồ thị, đường cong này được biểu diễn bằng đường đứt nét.
32.8.
Hướng dẫn. Các phản ứng điều chế :
– đặc tác dụng với Cu.
– đặc nóng tác dụng với S.
– Đốt cháy S trong oxi.
– Đốt cháy trong oxi.
– Dung dịch loãng tác dụng với
ở trạng thái rắn hoặc dung dịch. Viết tất cả các PTHH của các phản ứng.
32.9*.
a) Công thức phân tử của hợp chất A :
– Số mol các sản phẩm của phản ứng :
n = 0,1 mol; n
= 0,1 mol.
– Khối lượng của hiđro có trong 0,1 mol (2 g.0,1 = 0,2 g) và khối lượng của lưu huỳnh có trong 0,1 mol
(32 g.0,1 = 3,2 g) đúng bằng khối lượng của hợp chất A đem đốt (3,4 g).
Vậy thành phần của hợp chất A chỉ có 2 nguyên tố là H và S.
– Tỉ lệ giữa số mol nguyên tử H và số mol nguyên tử S là :
:
= 0,1.2 : 0,1 = 2 : 1
Công thức phân tử của hợp chất A là : .
b) PTHH của phản ứng đốt cháy :
→
c) Nồng độ phần trăm của các chất trong dung dịch :
– Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol (0,1 mol), vậy sản phẩm là muối
. Ta có PTHH :
→
+
– Khối lượng của dung dịch sau phản ứng :
mdd = 146,6+ 3,4 =150 (g)
– Khối lượng các chất có trong dung dịch sau phản ứng :
m () = 126.0,1 = 12,6 (g)
m (NaOHdư) = 40.(0,3 – 0,2) = 4 (g) NaOH
– Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C% = ( 12,6/150 ).100% = 8,4%
C%NaOHdư = ( 4/150) . 100% ≈ 2,67%.
32.10.
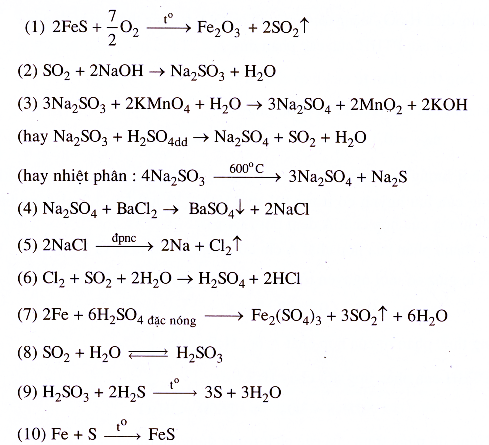
32.11.
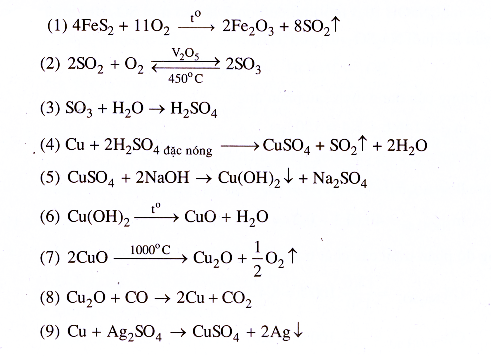
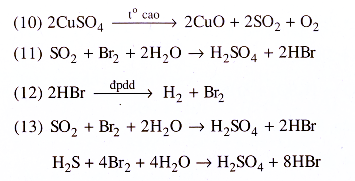
32.12.
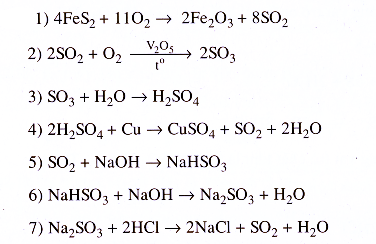
32.13.
a) Dung dịch để lâu ngày bị vẩn đục do bị
trong không khí oxi hoá :
![]()
b) Do khí có tính khử mạnh nên nó tác dụng luôn với các chất oxi hoá như
của không khí hoặc
có trong khí thải của các nhà máy.
c) Do bạc tác dụng với và khí
có trong không khí tạo ra bạc sunfua có màu xám đen.
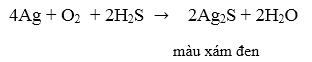
d) Nhận biết được khí bằng dung dịch
do phản ứng tạo ra chất kết tủa màu đen.
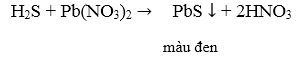
32.14.

32.15.

32.16.
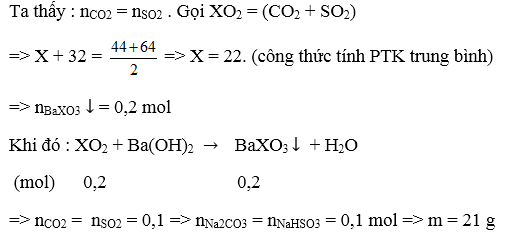
32.17.
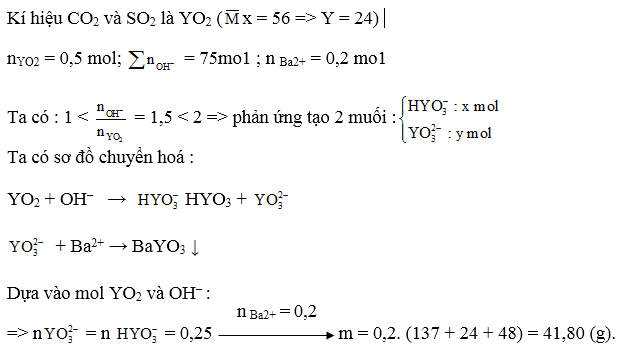
32.18.

32.19.
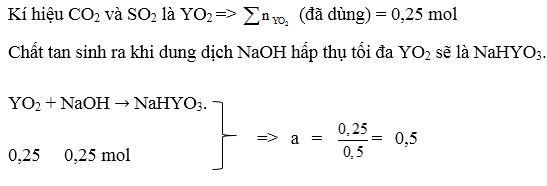



Trackbacks