Bài 9 – Amin
ĐÁP ÁN
9.1 C
9.2 D
9.3 C , .
Hướng dẫn : Các amin C7H9N có chứa vòng benzen là
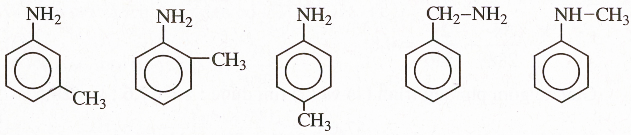
9.4 C
9.5 D
9.6. A
9.7 D
9.8 C
9.9 D
9.10 Lắc kĩ hỗn hợp dung dịch HCl dư, chỉ có anilin phản ứng:
C6H5 – NH2 + HCl → [C6H5 – NH3]+Cl
anilin phenylamoni clorua
Sau đó để yên, có hai lớp chất lỏng tạo ra: một lớp gồm nước hòa tan phenylamoni clorua và HCl còn dư, lớp kia gồm benzen hòa tan phenol.
Tách riêng lớp có nước rồi cho tác dụng với NH3 lấy dư :
HCl + NH3 NH4Cl
[C6H5 – NH3]+ Cl– + NH3 C6H5NH2 + NH4CI
Anilin rất ít khi tan trong nước nên có thể tách riêng
Lắc kĩ hỗn hợp benzen và phenol với dung dịch NaOH dư :
C6H5OH + NaOH → C6H5ONa + H2O
natri phenolat
Natri phenolat tan trong nước còn benzen không tan và được tách riêng. Thổi CO2 dư qua dung dịch có chứa natri phenolat:
NaOH + CO2 → NaHCO3
C6H5ONa + CO2 + H2O → NaHCO3 + C6H5OH
Phenol rất ít tan trong nước lạnh và được tách riêng.
9.11 C3H8 + 5O2 → 3CO2 + 4H2O
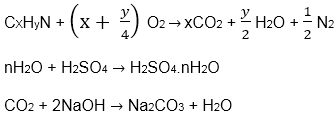
Thể tích hơi nước : 43 – 21 = 22 (lít)
Thể tích CO2 : 21 – 7 = 14 (lít)
Để tạo ra 22 lít hơi nước cần 11 lít O2 (vì để tạo ra 1 mol H2O cần 0,5 mol O2)
Để tạo ra 14 lít CO2 cần 14 lít O2 (vì để tạo ra 1 mol CO2 cần 1 mol O2)
Thể tích O2 đã tham gia phản ứng : 14 + 11 = 25 (lít)
Thể tích O2 còn dư : 30 – 25 = 5 (lít)
Thể tích N2 : 7 – 5 = 2 (lít)
Thể tích CxHyN = 2.thể tích N2 = 4 (lít) ‘
Thể tích C3H8 = 6 – 4 = 2 (lít)
Khi đốt 2 lít C3H8 thu được 6 lít CO2 và 8 lít hơi nước. Vậy khi đốt 4 lít CxHyN thu được 14 – 6 = 8 (lít) CO2 và 22 – 8 = 14 (lít) hơi nước.
![]()
Công thức phân tử của amin là C2H7N.
Các công thức cấu tạo : CH3 – CH2 – NH2 ; CH3 – NH – CH3
etylamin đimetylamin
9.12 Thể tích hơi nước : 615 – 345 = 270 (ml).
Thể tích khí CO2 : 345 – 25 = 320 (ml).
Để tạo ra 320 ml COọ cần 320 ml O2 (vì để tạo ra 1 mol CO2 cần 1 mol O2).
Để tạo ra 270 ml hơi nước cần 135 ml O2 (vì để tạo ra 1 mol H2O cần 0,5 mol O2).
Thể tích O2 tham gia phản ứng : 320 + 135 = 455 (ml).
Thể tích O2 còn dư : 470 – 455 = 15 (ml).
Thể tích N2: 25 – 15 = 10 (ml).
Thể tích CH3NH2 = 2.thể tích N2 = 2.10 = 20 (ml).
Thể tích hai hiđrocacbon : 100 – 20 = 80 (ml).
Khi đốt 20 ml CH3NH2 tạo ra 20 ml CO2 và 50 ml hơi nước.
Khi đốt 80 ml hiđrocacbon tạo ra 300 ml CO2 và 220 ml hơi nước.
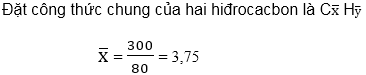
Vậy một hiđrocacbon có 3 nguyên tử cacbon và một hiđrocacbon có 4 nguyên tử cacbon.
![]()
Hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng khác nhau 2 nguyên tử hiđro và số nguyên tử hiđro trong mỗi phân tử hiđrocacbon phải là số chẵn. Vì vậy, với y = 5,5, có thể biết được một chất có 4 và một chất có 6 nguyên tử hiđro.
Đặt thể tích C3H4 là a ml, thể tích C4H6 là b ml, ta có :
a + b = 80
Thể tích CO2 là : 3a + 4b = 300
Do đó a = 20 ; b = 60
Vậy C3H4 chiếm 20% và C4H6 chiếm 60% thể tích của hỗn hợp.




Trackbacks