Bài 3 – Khái niệm xà phòng và chất giặt rửa tổng hợp
Đáp án
3.1 A
3.2 B
3.3 B
Trong xà phòng luôn có một lượng xút dư ; các muối natri của các axit béo bị thuỷ phân tạo ra môi trường kiềm có thể ăn mòn nhôm.
3.4 – Xà phòng là hỗn hợp muối natri (hoặc muối kali) của axit béo, có thêm một số chất phụ gia.
– Muối natri (hay muối kali) trong xà phòng có khả năng làm giảm sức căng bề mặt của các chất bẩn bám trên vải, da, … do đó vết bẩn được phân tán thành nhiều phần tử nhỏ hơn và được phân tán vào nước.
– Không nên dùng xà phòng để giặt rửa trong nước cứng vì sẽ tạo ra các muối khó tan của các axit béo với các ion Ca2+ và Mg2+ làm hạn chế khả năng giặt rửa.
3.5 Hướng dẫn :
Xà phòng không tiện dụng trong nước cứng ; Phải khai thác từ các nguồn dầu mỡ động vật, thực vật : làm cạn kiệt nguồn tài nguyên, phá huỷ môi trường, phải tốn nhiều thời gian nuôi trồng, chăm sóc. Phụ thuộc nhiều vào thời tiết, mùa vụ.
3.6 Chất béo có công thức (C17H33COO)3C3H5 tác dụng với kiềm :
(C17H33COO)3C3H5 + 3KOH → 3C17H33COOK + C3H5(OH)3 (1)
Phản ứng trung hoà axit:
RCOOH + KOH → RCOOK + H2O (2)
![]()
Số gam KOH để trung hoà axit béo là 700g ứng vói số mol KOH là 12,5 mol.
Theo (2): nRCOOH = nKOH
nnước sinh ra = nRCOOH = 12,5 mol
mnước sinh ra = 12,5.18 = 225 (g)
Số mol KOH tham gia phản ứng (1) là : 251,786 – 12,5 = 239,286 (mol).
![]()
Áp dụng định luật bảo toàn khối lượng :
mmuối = mchất béo mKOH – nước – mglixerol
= 100 000 + 14 100 – 225 – 79,762.92
= 106536,896 (g) ≈ 106,54 (kg).
3.7 Phản ứng của các chất với dung dịch NaOH :
(C17H35COO)3C3H5 + 3NaOH -> 3C17H35COONa + C3H5(OH)3 (C17H33COO)3C3H5 + 3NaOH -> 3C17H33COONa + C3H5(OH)3
(C15H31COO)3C3H5 + 3NaOH -> 3C15H31COONa + C3H5(OH)3
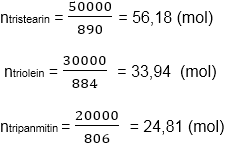
Khối lượng muối thu được :
m = 3(56,18,306 + 33,94.304 + 24,81.278) = 103218,06 (g) ≈ 103,2 (kg).




Comments mới nhất