Đáp án Bài 9
9.1. C.
9.2. D.
9.3. C.
9.4. C.
9.5. A.
9.6. A.
9.7. B.
9.8. B.
9.9. A.
9.10. B.
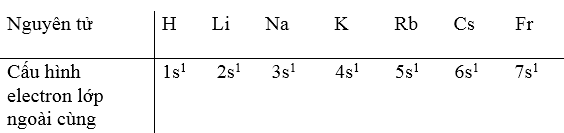
9.11.
a) Trong cùng một chu kì, khi đi từ trái sang phải theo chiều tăng của điện tích hạt nhân thì số electron hoá trị tăng dần.

b) Trong cùng một nhóm A, số electron hoá trị của các nguyên tử đều như nhau và bằng số thứ tự của nhóm.
9.12.
a) Trong cùng một chu kì, khi đi từ trái sang phải theo chiều tăng của số đơn vị điện tích hạt nhân thì bán kính nguyên tử giảm dần.
Giải thích : Trong cùng một chu kì, số lớp electron trong nguyên tử của các nguyên tố bằng nhau nhưng vì điện tích hạt nhân tăng, lực hút của hạt nhân với các electron cũng tăng theo làm cho bán kính nguyên tử của các nguyên tố giảm dần.
b) Trong cùng một nhóm A, theo chiều từ trên xuống dưới, bán kính, nguyên tử tăng.
Giải thích : Theo chiều từ trên xuống dưới, điện tích hạt nhân tăng nhưng đồng thời số lớp electron cũng tăng và chiếm ưu thế nên kết quả là bán kính nguyên tử tăng theo.
9.13.
a) Trong cùng một chu kì, khi đi từ trái sang phải ,(không xét các khí hiếm), độ âm điện của các nguyên tử tăng.
Giải thích : Trong một chu kì, khi đi từ trái sang phải, điện tích hạt nhân tăng, bán kính nguyên tử giảm nên lực hút electron của nguyên tử tăng.
b) Trong cùng một nhóm A, khi đi từ trên xuống dưới, độ âm điện của các nguyên tử giảm dần.
Giải thích : Trong cùng một nhóm A, khi đi từ trên xuống dưới ; bán kính nguyên tử tăng nên lực hút electron của nguyên tử giảm.
9.14. Khi không xét các khí hiếm, độ âm điện tăng từ trái sang phải và giảm dần từ trên xuống dưới. Nguyên tử F đứng ở góc trên, phía phải nên flo có độ âm điện lớn nhất.
9.15.
Trong cùng một chu kì, bán kính nguyên tử giảm khi đi từ trái sang phải.
Vì vậy, đối với 4 trong số 5 nguyên tử trên, bán kính nguyên tử tăng dần theo thứ tự : Cl, P, Al, Na.
Trong cùng một nhóm, bán kính nguyên tử tăng theo số thứ tự của chu kì nên bán kính nguyên tử của F nhỏ hơn bán kính của Cl.
Tóm lại, bán kính nguyên tử tăng theo thứ tự :
F, Cl, P, Al, Na.
9.16. Trong cùng một chu kì, độ âm điện tăng dần từ trái sang phải, vì vậy đối với 4 trong số 5 nguyên tử trên độ âm điện tăng dần theo thứ tự :
Na, Al, P, Cl.
Trong cùng một nhóm, độ âm điện tăng từ dưới lên trên nên độ âm điện của Cl nhỏ hơn độ âm điện của F. Tóm lại, độ âm điện tăng theo thứ tự :
Na, Al, P, Cl, F.
9.17.
a) Tính kim loại của một nguyên tố càng mạnh thì tính phi kim của nó càng yếu.
b) Trong cùng một chu kì, tính phi kim của các nguyên tố tăng dần từ trái sang phải.
Trong cùng một nhóm (nhóm A) tính phi kim của các nguyên tố giảm dần từ trên xuống dưới.
Tính kim loại biến thiên ngược chiều với tính phi kim.
9.18.
a) Độ âm điện của một nguyên tố càng lớn thì tính phi kim của nguyên tố đó càng mạnh.
b) Trong bảng tuần hoàn các nguyên tố thì tính phi kim của các nguyên tố biến thiên cùng chiều với độ âm điện của chúng.
9.19.
Chu kì 2 : .
Chu kì 3 : .
9.20. Trong cùng một chu kì, khi đi từ trái sang phải, tính bazơ của các oxit và hiđroxit của các nguyên tố yếu dần, đồng thời tính axit của chúng mạnh dần.
9.21.

9.22.
Tính phi kim :
N(Z = 7) > P(Z = 15), vì trong nhóm tính phi kim giảm khi Z tăng.
Tính phi kim :
F (Z = 9) > O (Z = 8) > N (Z = 7), vì trong chu kì tính phi kim tăng khi Z tăng.
Vậy chiều giảm dần tính phi kim là :
F (Z = 9) > O (Z = 8) > N (Z = 7) > P (Z = 15).



Trackbacks