I.KIẾN THỨC CẦN NHỚ
1.Tính chất hóa học của muối
a.Muối tác dụng với một số kim loại tạo thành muối mới và kim loại mới.
b.Muối tác dụng với axit tạo thành muối mới và axit mới (phản ứng trao đổi).
c.Muối tác dụng với muối tạo thành hai muối mới (phản ứng trao đổi).
d.Muối tác dụng với bazơ tạo thành muối mới và bazơ mới (phản ứng trao đổi).
e.Phản ứng phân hủy muối: Nhiều muối bị phân hủy ở nhiệt độ cao.
![]()
2.Phản ứng trao đổi
-Định nghĩa: Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới không tan hoặc chất khí.
-Điều kiện xảy ra phản ứng trao đổi:
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
3.Phân loại
a.Muối trung tính (trung hòa)
Là muối mà trong phân tử không chứa nguyên tử hiđro.
Ví dụ: Na2CO3, Na2SO3,…
b.Muối axit
Là muối mà trong phân tử có chứa nguyên tử hiđro.
Ví dụ: NaHCO3, NaH2PO4,…
c.Tên gọi
-Tên muối trung hòa = tên kim loại (hóa trị nếu cần) + tên gốc axit. Ví dụ: Na2CO3; natri cacbonat.
-Tên gọi muối axit = tên kim loại + tiếp đầu ngữ + hiđro + tên gốc axit.
Ví dụ: NaH2P04: natri hiđrophotphat.
4.Tính tan
Tính tan của muối trong nước góp phần quyết định sự hình thành phản ứng hóa học của nó với muối, axit hay bazơ.
Lưu ý:
-Tất cả muối nitrat đều tan.
-Tất cả muối clorua đều tan (trừ AgCl, PbCl2, CuCl, HgCl2).
-Tất cả muối sunfat đều tan (trừ Ag2SO4) CaSO4, PbSO4, Hg2SO4)
-Tất cả muối cacbonat đều không tan (trừ K2CO3, Na2CO3,(NH4)2CO3).
-Tất cả muối photphat đều không tan (trừ photphat kim loại kiềm, photphat amoni).
-Ngoài ra, học sirih cần tham khảo thêm bảng tính tan.
II.GIẢI BÀI TẬP
Giải Bài 1. Trang 33 sách giáo khoa hóa học 9
a.Tạo ra chất khí:
Dung dịch Na2S03 hoặc Na2CO3 tác dụng với dung dịch axit (HCl hoặc H2SO4).
Na2SO3 + 2HCl → 2NaCl + H2O + SO2↑
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 ↑
b.Tạo ra chất không tan.
Dung dịch muối BaCl2 với dung dịch axit sunfuric hay muối natri sunfat:
BaCl2 + Na2SO4 → 2NaCl + BaSO4 ↓
BaCl2 + H2SO4 → BaS04 ↓+ 2HCl
Giải Bài 2. Trang 33 sách giáo khoa hóa học 9
Cách 1: Bằng mắt thường ta nhận biết lọ đựng dung dịch CuSO4 vì có màu xanh lam ,hai lọ còn lại ta sử dụng dung dịch NaCl để thử. Lọ có kết tủa trắng là AgNO3, lọ không có hiện lượng là NaCl.
NaCl + AgNO3 → AgCl ↓ + NaNO3
Cách 2 (mở rộng): Lấy 3 mẫu thử và đánh dấu.
-Cho dung dịch HCl vào 3 mẫu. Mẫu nào tạo kết tủa là AgNO3.
AgNO3 + HCl → AgCl ↓ + HNO3
-Cho NaOH vào 3 mẫu.
Mầu nào tạo kết tủa xanh là CuSO4.
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
-Còn lại là dung dịch NaCl.
Giải Bài 3. Trang 33 sách giáo khoa hóa học 9
a.Phản ứng với dung dịch NaOH: Mg(NO3)2 và CuCI2
Mg(N03)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3
CuCI2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
b.Không có chất nào đã cho phản ứng với dung dịch HCl.
c.Phản ứng với dung dịch AgNO3.
CuCI2+ 2AgNO3 → 2AgCl ↓ + Cu(NO3)2
Giải Bài 4. Trang 33 sách giáo khoa hóa học 9
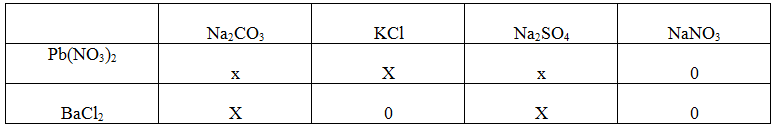
Pb(NO3)2 + Na2CO3 → PbCO3↓ + 2NaNO3
Pb(NO3)2 + 2KCl → PbCl2↓ + 2KNO3
Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2NaNO3
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
BaCl2 + Na2SO4→ BaSO4↓ + 2NaCl
Giải Bài 5. Trang 33 sách giáo khoa hóa học 9
-Chọn đáp án C. Một phần đinh sắt bị hòa tan, kim loại đồng bám ngoài đinh sắt, màu xanh lam của dung dịch ban đầu nhạt dần.
Giải Bài 6. Trang 33 sách giáo khoa hóa học 9
a.Hiện tượng quan sát được và phương trình hóa học.
Tạo ra kết tủa trắng là AgCl.
CaCl2 + 2AgNO3 → 2AgCl ↓ + Ca(NO3)2
0,005mol 0,01 mol 0,01mol 0,005mol
b.Khối lượng chất rắn sinh ra
nCaCl = 2,22 : (40 + 71) = 0,02 (mol)
nAgNO3 = 1,70 : 170 = 0,01 (mol)
Chất phản ứng hết là AgNO3, số mol AgCl = 0,01.
=> mAgCl = 143,5 x 0,01 = 1,435 (g)
Số liệu bài đã cho chính xác đến 0,01g cho nên cần làm tròn số liệu đã tính toán.
Khối lượng AgNO3 thu được sấp sỉ 1,44(g).
c.Tính nồng độ mol/l của chất còn lại trong dung dịch.
Để giải được ý (c) phải chấp nhận sai số. Khi trộn 2 dung dịch, thể tích chung thường không phải là phép tính cộng hai thể tích của 2 dung dịch đầu. Thể tích chung có thể nhỏ hơn hoặc lớn hơn tổng thể tích đầu. Trong bài tập này ta chấp nhận một cách gần đúng thể tích chung bằng tổng thể tích của hai chất ban đầu.
phản ứng = 0,02 – 0,005 = 0,015 (mol)
V = 0,07 + 0,03 = 0,1 (l)
CMCaCl2 = 0,015 : 0,1= 0,15 (M)
nCa(N03)2 sấp sỉ 0,005 (mol)
=>CMCa(NO3)2=0,005 : 0,1 =0,05 (M)

Comments mới nhất