I.KIẾN THỨC CẦN NHỚ
1.Tính chất vật lý
Etilen là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí d = 28/29
2.Cấu tạo phân tử
Giữa hai nguyên tử cacbon là liên kết đôi. Trong liên kết đôi có một liên kêt kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học.
3.Tính chất hóa học
a.Khi đốt, etilen cháy tạo ra khí cacbonic, hơi nước và toả nhiệt
Phản ứng với oxi (phản ứng cháy):
![]()
b.Etilen làm mất màu dung dịch brom.
Phản ứng với dung dịch brom:
CH2 = CH2 (k) + Br2 (dd) → Br – CH2 – CH2 – Br (l)
Đibrometan
Phản ứng giữa etilen với dung dịch brom gọi là phản ứng cộng. Các chất có liên kết đôi (tương tự etilen) dễ tham gia phản ứng cộng.
c.Phản ứng trùng hợp
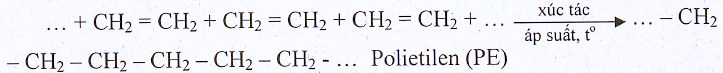
4.Ứng dụng
-Etilen là nguyên liệu để điều chế nhựa polietilen, rượu etylic, axit axetic…
-Dùng để kích thích quả mau chín.
II.GIẢI BÀI TẬP
Bài 1. Trang 119 sách giáo khoa hóa học 9
a.Có một liên kết đơn.
b.Có một liên kết đôi.
c.Có hai liên kết đôi xen kẽ một liên kết đơn.
Bài 2. Trang 119 sách giáo khoa hóa học 9
 Bài 3. Trang 119 sách giáo khoa hóa học 9
Bài 3. Trang 119 sách giáo khoa hóa học 9
Dẫn khí metan lẫn tạp chất đi qua dung dịch brom.
C2H4 + Br2 → C2H4Br2
Metan không tác dụng với dung dịch brom. Ta thu được metan tinh khiết.
Bài 4. Trang 119 sách giáo khoa hóa học 9
a.Số mol C2H4: nC2H4 = 4,48/22,4 = 0,2 (mol)
C2H4 + 3O2 → 2CO2↑ + 2H2O
2mol 0,3mol
Thể tích oxi: VO2 = 0,3 x 22,4 = 6,72 (l)
b.Thể tích không khí.
Vkk = 5 x 6,72 = 33,6 (l)

Comments mới nhất