Bài 1. Trang 103 sách giáo khoa hóa học 9
Các phương trình hóa học:
S + H2 → H2S (1)
S + Fe → FeS (2)
S + O2 → SO2 (3)
Bài 2. Trang 103 sách giáo khoa hóa học 9
Các phương trình hóa học:
H2 + Cl2→ 2HCl (1)
2Na + Cl2 → 2NaCl (2)
2NaOH + Cl2 → NaCl + NaClO + H2O (3)
H2O + Cl2 → HCl + HClO (4)
Bài 3. Trang 103 sách giáo khoa hóa học 9
Các phương trình hóa học:
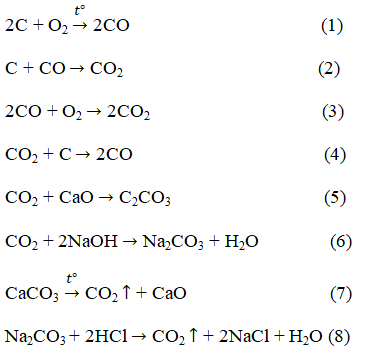
Bài 4. Trang 103 sách giáo khoa hóa học 9
-A là Na, có 3 lớp electron: 2, 8, 1.
-Tính chất hóa học đặc trưng là tính kim loại.
-Tính kim loại của Na mạnh hơn của Mg (12) và Li (3).
-Tính kim loại của Na yếu hơn của K (19).
Bài 5. Trang 103 sách giáo khoa hóa học 9
a.Trong 32g FexOy có 32 – 22,4 = 9,6 g oxi
Ta có tỷ số :
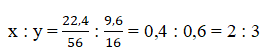
Công thức của oxit sắt là Fe2O3.
b.Phương trình hóa học
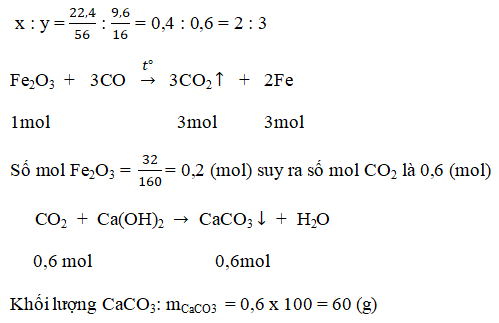
Bài 6. Trang 103 sách giáo khoa hóa học 9
Số mol MnO2 :
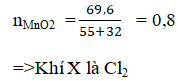
MnO2 + 4HCl → MnCl2 + Cl2 ↑ + 2H2O
0,8mol 0,8mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8mol 1,6mol 0,8mol 0,8mol
Số mol NaOH ban đầu: nNaOH ban đầu = 4 x 0,5 = 2 (mol)
Số mol NaOH dư : nNaOH dư = 2 – 1,6 = 0,4 (mol)
Số mol NaOH dư : nNaOH dư = 2 – 1,6 = 0,4 (mol)
CMNaCl = CMNaClO = 0,8 : 0,5 = 1,6 M
CMNaOH = 0,4 : 0,5 = 0,8 M

Comments mới nhất