I.KIẾN THỨC CẦN NHỚ
1.Axit cacbonic (H2CO3)
a.Trạng thái tự nhiên và tính chất vật lí
-Khí CO2 tan được trong nước tạo thành dung dịch H2CO3
-Tỉ lệ thể tích:
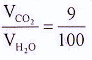
-Nước tự nhiên và nước mưa có hòa tan khí cacbonic:
1000 cm3 nước hòa tan được 90 cm3 khí CO2. Một phân khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2 trong khí quyển. Khi đun nóng, khí CO2 bay ra khỏi dung dịch. Trong nước mưa cũng có axit cacbonic do nước hòa tan khí CO2 có trong khí quyển.
b.Tính chất hóa học
-H2CO3 là một axit yếu: dung dịch H2CO3 làm quỳ tím chuyển thành màu đỏ nhạt.
-H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
H2CO3 → CO2 + H2O
2.Muối cacbonat
a.Phân loại
-Khái niệm: Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
-Phân loại: có hai loại muối:
+ Muối trung hòa: Muối cacbonat.
Cacbonat trung hòa là muối cacbonat không còn nguyên tố H trong thành phần gốc axit.
Ví dụ: CaCO3, Na2CO3, MgCO3,…
+ Muối axit: Cacbonat axit.
Gọi là muối hiđrocacbonat, có nguyên tố H trong thành phần gốc axit.
Ví dụ: Ca(HCO3)2,NaHCO3, KHCO3,…
b.Tính chất
-Tính tan
+ Đa số muối cacbonat không tan trong nước, trừ một số muối cacbonat của kim loại kiềm như: Na2CO3, K2CO3,…
+ Hầu hết muối hiđrocacbonat tan trong nước như: Ca(HCO3)2, Mg(HCO3)2,…
-Tính chất hóa học
+ Tác dụng với axit
Muối cacbonat tác dụng với dung dịch axit mạnh hơn axit cacbonic tạo thành muối mới và giải phóng khí CO2.
NaHCO3(dd) + HCl (dd) → NaCl (dd) + H2O (l) + CO2(k)
Na2CO3(dd) + 2HCl (dd) → 2NaCl (dd) + H2O (l) + CO2(k)
+ Tác dụng với dung dịch bazơ
Một số dung dịch muối cacbonat phản ứng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới.
Chú ý: Muối hiđrocacbonat tác dụng với kiềm tạo thành muối trung hòa và nước. Ví dụ:
NaHCO3 (dd) + NaOH (dd) → Na2CO3(dd) + H2O (l)
+ Tác dụng với dung dịch muối
Dung dịch muối cacbonat có thế tác dụng với một số dung dịch muối khác tạo thành hai muối mới.
Na2CO3(dd) + CaCl2(dd) → CaCΟ3(r) + 2NaCl (dd)
+ Muối cacbonat bị nhiệt phân hủy.
Nhiều muối cacbonat (trừ muối cacbonat trung hòa của kim loại kiềm) dễ bị nhiệt phân hủy, giải phóng khí cacbonic.
![]()
NaHCO3 bị nhiệt phân hủy:
![]()
c.Ứng dụng
CaCO3 là thành phần chính của đá vôi, đá phấn, được dùng làm nguyên liệu sản xuât vôi, xi măng; Na2CO3 được dùng để nấu xà phòng, thủy tinh; NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa…
3.Chu trình cacbon trong tự nhiên
Trong tự nhiên luôn có sự chuyển hóa cacbon từ dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín được thể hiện trong hình 3.17 (SGK trang 90).
II.GIẢI BÀI TẬP
Bài 1. Trang 91 sách giáo khoa hóa học 9
Ví dụ chứng tỏ rằng H2CO3 là axit yếu hơn HCl và là axit không bền. Phương trình hóa học:
CaCO3 + 2HCl → CaCl2 + H2CO3
H2CO3 → H2O + CO2 ↑
Bài 2. Trang 91 sách giáo khoa hóa học 9
a.Tác dụng với dung dịch axit.
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
b.MgCO3 bị nhiệt phân hủy.
![]()
Bài 3. Trang 91 sách giáo khoa hóa học 9
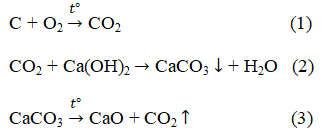
Bài 4. Trang 91 sách giáo khoa hóa học 9
-Các cặp chất có thể tác dụng với nhau là: a, c, d, e. Vì sản phẩm của phản ứng là chất khí hoặc chất không tan.
Phương trình hóa học:
a) H2SO4 + 2KHCO3 → K2SO4 + 2CO2↑ + 2H2O
b) MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O
c) CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl.
d) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH
Bài 5. Trang 91 sách giáo khoa hóa học 9
Phương trình hóa học:
H2SO4 + NaHCO3 → NaHSO4 + H2O + CO2↑
-Theo bài ra:
Số mol của dung dịch H2SO4 là:
![]()
Mà dung dịch H2SO4 phản ứng hết.
Tính theo số mol H2SO4.
-Theo phương trình hóa học:
nco2= nH1SO4= 10(mol)
Thể tích khí CO2 tạo thành (đktc):
VCO2= 10 x 22,4 = 224 (l)

Comments mới nhất