I.KIẾN THỨC CẦN NHỚ
1.Tính chất vật lý
-Clo là chất khí, màu vàng lục, mùi hắc.
-Clo nặng gấp 2,5 lần không khí và tan được trong nước.
-Clo là khí độc.
2.Tính chất hóa học
-Ngoài những tính chất hóa học của một phi kim như:
+ Tác dụng với hầu hết kim loại tạo thành muối clorua.
+ Tác dụng với hiđro tạo thành khí hiđro clorua.
-Clo còn có một số tính chất hóa học sau:
+ Tác dụng với nước tạo thành dung dịch nước clo:
![]()
Dung dịch nước clo là dung dịch hỗn hợp giữa CI2, HCl và HClO nên có màu vàng lục, mùi hắc của clo; dung dịch axit lúc đầu làm giấy quỳ chuyển sang màu đỏ nhưng nhanh chóng bị mất màu ngay sau đó do tác dụng oxi hóa mạnh của axít hipoclorơ (HCIO).
+ Tác dụng với dung dịch natri hiđroxit (NaOH) tạo thành dung dịch nước Javen:
Cl2(k) + 2NaOH (dd) → NaCl (dd) + NaClO (dd) + H2O (l)
Dung dịch nước Javen là hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO), có tính tẩy màu vì tương tự như axit hipoclorơ (HCIO), natri hipoclorit (NaClO) là chất oxi hóa mạnh.
+ Ngoài ra, Cl2 còn có thể tác dụng với kiềm dạng rắn ở nhiệt độ cao:
![]()
3.Điều chế
a.Trong phòng thí nghiệm:
Dùng chất oxi hóa mạnh như: MnO2, KMnO4, KCIO3, CaOCl2 … tác dụng với HCl đặc.
![]()
2KMnO4+ 16HCl → 2KCl + 2MnCl2+ 5Cl2↑+ 8H2O
b.Trong công nghiệp:
Điện phân dung dịch NaCl đậm đặc (có màng ngăn không cho khí Cl2 thoát ra tác dụng với NaOH trong dung dịch tạo ra nước Javen).
![]()
4.Ứng dụng
-Clo là một hóa chất quan trọng trong việc lảm tinh khiết nước, trong việc khử trùng hay tẩy trắng và là khí gây ngạt (mù tạc).
-Clo được sử dụng rộng rãi trong sản xuất của nhiều đồ vật sử dụng hàng ngày.
II.GIẢI BÀI TẬP
Bài 1. Trang 81 sách giáo khoa hóa học 9
-Dẫn khí clo vào nước xảy ra cả hiện tượng vật lý vả hiện tượng hóa học.
-Giải thích: Clo tan trong nước là hiện tượng vật lý.
Clo còn phản ứng với nước:
![]()
Bài 2. Trang 81 sách giáo khoa hóa học 9
Xem phần 2, (Kiến thức cần nhớ).
Bài 3. Trang 81 sách giáo khoa hóa học 9
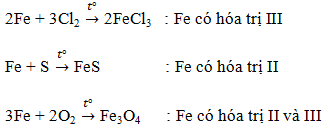
Bài 4. Trang 81 sách gỉáo khoa hóa học 9
Trường hợp b đúng vì xảy ra phản ứng hóa học:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Bài 5. Trang 81 sầch giáo khoa hóa học 9
Phương trình hóa học: CI2 + 2KOH → KCl + KClO + H2O
Bài 6. Trang 81 sách giáo khoa hóa học 9
Dùng tàn đóm đỏ để nhận ra khí oxi, tàn đóm sẽ bùng cháy thành ngọn lửa trong khí oxi.
Hai lọ còn lại dùng giấy quỳ tím tẩm ướt để phân biệt, nếu quỳ chuyến sang màu đỏ thì lọ đó đựng HCl, nếu quỳ tím mất màu thì đó là khí clo.
Bài 7. Trang 81 sách giáo khoa hóa học 9
Có thể sử dụng các chất oxi hóa như MnO2, KMnO4 tác dụng với dung dịch HCl đặc.
MnO2 + 4HCl → MnCI2+ Cl2 ↑ + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2+ 5Cl2 ↑ + 8H2O
Bài 8. Trang 81 sách giáo khoa hóa học 9
Trong công nghiệp, clo được điều chế ở quy mô lớn, giá thành rẻ bằng cách điện phân dung dịch muối ăn bão hoà có màng ngăn.
![]()
Bài 9. Trang 81 sách giáo khoa hóa học 9
-Không thế thu khí clo bằng cách đẩy nước vì clo phản ứng với nước và tan đáng kể trong nước.
-Có thể thu khí clo bằng cách đẩy khí, có thể dùng dụng cụ theo sơ đồ sau:
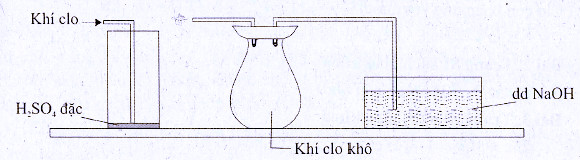
Theo thứ tự từ trái qua phải là binh rửa khí đụng H2SO4 đặc để hút ẩm, làm khô khí clo, bình thứ 2 đựng khí clo khô, bình thứ 3 đựng dung dịch NaOH để đề phòng khí clo đã đầy tràn ra không khí làm ô nhiễm.
Bài 10. Trang 81 sách giáo khoa hóa học 9
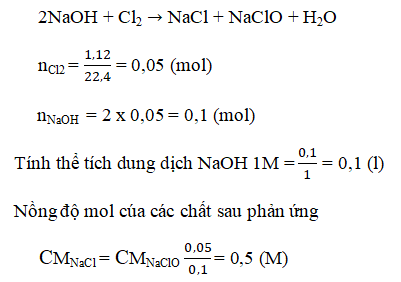
Bài 11. Trang 81 sách giáo khoa hóa học 9
Trong những bài xác định nguyên tố phải xác định khối lượng mol của nguyên tố đó rồi so sánh để biết đó là nguyên tố hóa học nào.
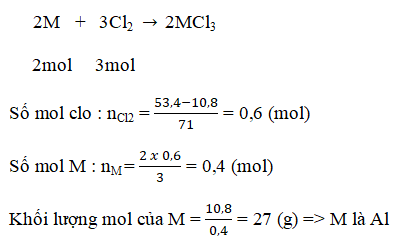

Comments mới nhất