Bài 1. Trang 71 sách giáo khoa
a.
2Fe + 3Cl2 → 2FeCl3 (1)
FeCl3 + 3NaOH→ Fe(OH)3 + 3NaCl (2)
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H20 (3)
Fe2 (S04)3 + 3BaCl2 → 2FeCl3 + 3BaS04 ↓ (4)
b.
//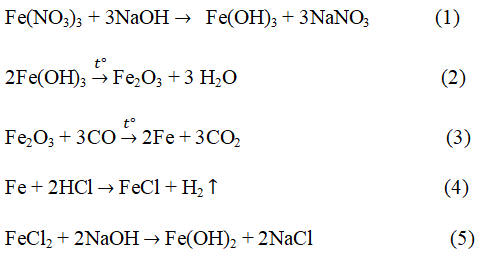
Bài 2. Trang 72 sách giáo khoa hóa học 9
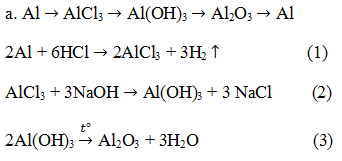
![]()
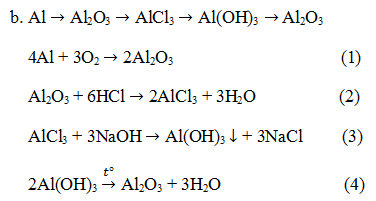
Bài 3. Trang 72 sách giáo khoa hóa học 9
-Lấy 3 mẫu kim loại cho tác dụng với dung dịch HCl, kim loại không phản ứng là Ag.
2Al + 6HCl→ 2AICI3 + 3H2 ↑ (1)
Fe + 2HC1l →FeCl2 + H2 ↑ (2)
-Nhỏ từ từ dung dịch NaOH vào hai ống nghiệm đựng 2 dung dịch thu được ở thí nghiệm trên, nếu xuất hiện kết tủa trắng sau đó khí dư kiềm kết tủa tan thì kim loại ban đầu là Al.
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl (3)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (4)
-Nếu chỉ xuất hiện kết tủa màu trắng xanh, kết tủa dần chuyển sang màu nâu trong không khí thì kim loại ban đầu là Fe.
FeCl2 + 2NaOH → Fe(OH)2 ↓ + 2NaCl (5)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (r) màu nâu đỏ (6)
Bài 4. Trang 72 sách giáo khoa hóa học 9
-Không phải A vì có Cu là kim loại đứng sau H.
-Không phải B vì có Ag là kim loại đứng sau H.
Không phải C vì NaCl không tác dụng với H2SO4 loãng.
Phương án đúng là D. Al, AI2O3, Fe(OH)2, BaCl2 tác dụng với H2SO4 loãng.
Bài 5. Trang 72 sách giáo khoa hóa học 9
-Không phải A vì có CuO là oxit bazơ không tác dụng với kiềm.
-Không phải C vì có KNO3 là muối của kim loại kiềm.
-Không phải D vì có MgO là oxit bazơ không tác dụng với kiềm.
Phương án đúng là B. H2SO4, SO2, CO2, FeCl2 tác dụng với dung dịch NaOH.
Bài 6. Trang 72 sách giáo khoa hóa học 9
Phương án tốt nhất là dùng nước vôi trong.
Bài 7. Trang 72 sách giáo khoa hóa học 9
Cho bạc lẫn tạp chất là nhôm và đồng vào dung dịch AgNO3 dư.
AI + 3AgNO3 → Al(NO3)3 + 3Ag
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Sau khi phản ứng hoàn toàn ta lọc sẽ thu được Ag tinh khiết.
Bài 8. Trang 72 sách giáo khoa hóa học 9
-H2SO4 đặc có thể làm khô cả 3 khí trên: khí SO2,O2, CO2.
-CaO chỉ làm khô được khí O2. Bởi vì CaO có thể phản ứng với các khí SO2, CO2.
Bài 9. Trang 72 sách giáo khoa hóa học 9
Khối lượng muối sắt clorua = 10 x 32,5% = 3,25 (g)
Khối lượng muối AgCl: mAgCl = 8,61 (g)
Số mol AgCl: nAgCl = 8,61/143,5 =0,06 (mol)
Khối lượng của clo: mCl = 0,06 x 35,5 =2,13 (g)
Khối lượng của Fe: mFe = 3,25 – 2,13 = 1,12 (g)
Số mol Fe: nFe = 1,12 / 56 = 0,02 (mol)
Gọi công thức muối là FexOy ta có tỷ lê x/y = 0,02/0,06 hay x = 1, y = 3.
Công thức muối cần tìm là FeCl3.
Bài 10. Trang 72 sách giáo khoa hóa học 9
a.Viết phương trình hóa học
Fe + CuSO4 → FeSO4 + Cu
1mol 1mol 1mol 1mol
b.Xác định nồng độ mol các chất sau phán ứng:
Số mol Fe : nFe = 1,96 / 56 = 0,035 (mol) => số mol FeSO4: nFeS0 = 0,035 (mol)
Số mol CuSO4 : nCuSO4 = (100 x 1,12 x 10) / (100 x 160) = 0,07 (mol)
=> Số mol CuSO4: nCuSO4 dư = 0,035 (mol)
CMCuSO4 = CMFeSSO4 = 0,035 / 0,1 = 0,35 (M)

Comments mới nhất