I.KIẾN THỨC CẦN NHỚ
1.Muối natri clorua (NaCl)
a.Trạng thái tự nhiên
-Muối natri clorua tồn tại ở dạng hòa tan trong nước biển. Phơi nước biển sẽ thu được một hỗn hợp các muối, trong đó thành phần chính là NaCl.
-Ngoài ra, muối NaCl còn tồn tại trong lòng đất dưới dạng muối mỏ.
b.Cách khai thác
-Người ta khai thác NaCl từ nước mặn ở biển hoặc hồ nước mặn bằng cách cho bay hơi từ từ, thu được muối kết tinh.
-Ở những nơi có mỏ muối, khai thác bằng cách đào hầm hoặc giếng sâu qua các lớp đất, đá đến mỏ muối. Muối mò sau khi khai thác được nghiền nhỏ và tinh chế để có muối sạch.
c.Ứng dụng quan trọng của muối NaCl
-Chế tạo hợp kim.
-Chất trao đổi nhiệt.
-Sản xuất thủy tinh.
-Chế tạo xà phòng.
-Chất tẩy rửa tổng hợp.
-Làm gia vị và bảo quản thực phẩm.
-Dùng để sản xuất: Na; H2; CI2; NaOH; Na2CO3; NaHCO3.
2.Muối kali nitrat (KNO3)
a.Tính chất
Muối KNO3 tan nhiều trong nước, bị phân hủy ở nhiệt độ cao. Muối KNO3 có tính chất oxi hóa mạnh.
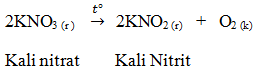
b.Ứng dụng:
-Chế tạo thuốc nổ đen.
-Làm phân bón (cung cấp nguyên tố nitơ và kali cho cây trồng).
-Bảo quản thực phẩm trong công nghiệp.
II.GIẢI BÀI TẬP
Giải Bài 1, Trang 36 sách giáo khoa hóa học 9
a.Pb(NO3)2
b.NaCl
c. CaCO3
d.CaSO4
Giải Bài 2. Trang 36 sách giáo khoa hóa học 9
a.Axit + bazơ:
NaOH + HCl → NaCl + H2O
b.Axit + muối:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2t
c.Kiềm + muối:
2NaOH + CuCl2 →2NaCl + Cu(OH)2 ↓
d.Muối + muối:
Na2CO3 + CaCl2 →2NaCl + CaCO3 ↓
Giải Bài 3. Trang 36 sách giáo khoa hóa học 9
![]()
![]()
b.
*Khí clo (CI2) dùng để:
-Sản xuất chất dẻo PVC.
-Chất diệt trùng, thuốc trừ sâu, diệt cỏ.
-Khử trùng nước, tẩy trắng vải sợi, bột giấy.
*Khí hiđro (H2) dùng để:
-Sản xuất nhiên liệu cho động cơ tên lửa.
-Nạp vào khí cầu, hàn cắt kim loại, chất khử.
-Sản xuất axit clohiđric, cacbonic, phân đạm.
*Natri hiđroxit (NaOH) dùng để :
-Chế tạo xà phòng.
-Công nghiệp giấy.
Giải Bài 4. Trang 36 sách giáo khoa hóa học 9
a. x;
PTHH: Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 (r) + 3Na2S04
b. x;
PTHH: CuSO4 + 2NaOH → Cu(OH)2 (r) + Na2SO4
(màu xanh)
Giải Bài 5. Trang 36 sách giáo khoa hóa học 9
a.Viết các phương trình hóa học:
2KCIO3 → 2KC1 + 3O2↑ (1)
2mol 3mol
0,1mol 0,15 mol
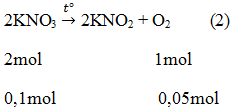
b.Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau.
0,1 mol KClO3 thu được 0,15 mol oxi hay VO2 = 0,15 X 22,4 = 3,36 (l)
0,1 mol KNO3 thu được 0,05mol oxi hay Vo2= 0,05 X 22,4 = 1,12 (1)
c.Khối lượng KCIO3 = 0,2 : 6 x 122,5 = 4,08 (g)
Khối lượng KNO3 = 0,1 x 101 = 10,1 (g)

Comments mới nhất